ATP合酶(又稱為F0F1-ATP酶或復(fù)合物V),是人體線粒體內(nèi)最重要的分子機(jī)器,,負(fù)責(zé)將生物外界攝入的食物中的能量轉(zhuǎn)化到機(jī)體細(xì)胞所能利用的能量?jī)?chǔ)存模塊ATP分子中去,。人體95%的ATP由它所合成。為了解釋ATP合酶的工作機(jī)理,,Paul D. Boyer提出“旋轉(zhuǎn)催化假說(shuō)”,。1994年,英國(guó)MRC結(jié)構(gòu)生物學(xué)家John Walker通過(guò)X射線衍射技術(shù)獲得了2.8 ?分辨率下的牛心線粒體F1-ATP酶晶體結(jié)構(gòu)(目前《細(xì)胞生物學(xué)》教材的經(jīng)典內(nèi)容),,清晰地表明了F1上的3個(gè)β亞基的構(gòu)象明顯不同,,分別為結(jié)合ATP的緊密態(tài)、ADP即將釋放的開(kāi)放態(tài)以及無(wú)底物結(jié)合的松散態(tài),,從而有力地支持了“旋轉(zhuǎn)催化假說(shuō)”[1]基于二人的重要貢獻(xiàn),,Paul D. Boyer和John Walker共享了1997年諾貝爾化學(xué)獎(jiǎng)(各占1/4的獎(jiǎng)金,另一半獎(jiǎng)金由鈉鉀泵發(fā)現(xiàn)者Jens Christian Skou獲得),。在近六十年的研究過(guò)程中,,科學(xué)家初步揭開(kāi)了這一重要分子機(jī)器的神秘面紗,普遍認(rèn)為此類分子機(jī)器可以在線粒體內(nèi)膜形成的脊上以多聚二聚體的形式呈現(xiàn)雙排線狀排布,。但是這一重要分子機(jī)器的具體作用機(jī)制及調(diào)控機(jī)制,,乃至這一巨大分子機(jī)器的亞基組成以及完整結(jié)構(gòu)一直不是很清楚,。
2019年6月14日,我校藥學(xué)院兼職教授,、清華大學(xué)生命科學(xué)學(xué)院楊茂君研究團(tuán)隊(duì)在Science雜志發(fā)表題為Cryo-EM structure of the mammalian ATP synthase tetramer bound with inhibitory protein IF1的研究長(zhǎng)文,,藥學(xué)院是共同完成單位。該文突破性地發(fā)現(xiàn)并解析了哺乳動(dòng)物ATP合酶四聚體的構(gòu)成形式和高分辨率結(jié)構(gòu),。首次獲得了高等生物ATP合酶的完整結(jié)構(gòu),,提出了細(xì)胞內(nèi)調(diào)控ATP合酶的分子機(jī)理,為進(jìn)一步理解哺乳動(dòng)物ATP合酶的亞基組成,、調(diào)控機(jī)制,、以及其對(duì)線粒體形態(tài)的影響等提供了重要的結(jié)構(gòu)基礎(chǔ),同時(shí)也為以后教科書的更新提供了重要素材,。
楊茂君教授自從2008年在清華組建研究團(tuán)隊(duì)起,,就一直在線粒體呼吸鏈研究領(lǐng)域深耕,并取得了一系列重要研究成果,,首次在原子水平上闡明了線粒體呼吸鏈超級(jí)復(fù)合物的結(jié)構(gòu)[2],,隨后發(fā)現(xiàn)了線粒體呼吸鏈超超級(jí)復(fù)合物的存在,解析了這一目前世界上所解析的最大也是最復(fù)雜的哺乳動(dòng)物超大膜蛋白分子機(jī)器的結(jié)構(gòu),,并部分闡明了它的作用機(jī)制[3,4],。
在上述課題的進(jìn)展過(guò)程中,楊茂君團(tuán)隊(duì)持續(xù)性地發(fā)現(xiàn)含量極其稀少的具有H型分子結(jié)構(gòu)的顆粒的存在,,進(jìn)一步地分析表明這些顆粒應(yīng)該是一種ATP合酶四聚體復(fù)合物,,對(duì)應(yīng)于之前CN-PAGE中的高分子量條帶。隨后,,設(shè)計(jì)了一整套全新的,、完備的純化路線,獲得了大量高純度,、高均一性的蛋白樣品并制備了大量冷凍電鏡樣品,。經(jīng)過(guò)檢查后,發(fā)現(xiàn)部分樣品質(zhì)量非常好,,適合收集數(shù)據(jù),。
因?yàn)樵撍木垠w分子量大約為2.8兆道爾頓,呈現(xiàn)H狀分布,,體積巨大,,數(shù)據(jù)計(jì)算過(guò)程中需要大量計(jì)算資源?;诖?,決定采用一種全新的計(jì)算方法,將四聚體中四個(gè)ATP合酶分子分別重新居中然后單獨(dú)挖出來(lái),,而將X型中對(duì)角線上構(gòu)象相似的分子合并,。最終獲得了主要分為兩類的大量構(gòu)象一致的單個(gè)ATP合酶的顆粒,。在其后的計(jì)算中逐步將這兩類構(gòu)象不同的復(fù)合物分辨率提高到了原子分辨率水平。6.2 ?分辨率下的整體結(jié)構(gòu)表明兩個(gè)V形的ATP合酶二聚體近似垂直地排列在一起形成C2對(duì)稱的結(jié)構(gòu),,其中有六個(gè)位點(diǎn)對(duì)二聚體聚合成四聚體起主要作用,。從這一較低分辨率復(fù)合物中提取并解析的3.34和3.45?分辨率的亞結(jié)構(gòu)則對(duì)應(yīng)于E和DP兩個(gè)旋轉(zhuǎn)態(tài)。兩個(gè)狀態(tài)中的亞基是完全相同的,,均含有以前研究發(fā)現(xiàn)的18種亞基和一個(gè)新發(fā)現(xiàn)的k亞基(基于酵母的命名方式,,氨基酸組成并未鑒定出來(lái))。該結(jié)構(gòu)是目前發(fā)現(xiàn)的最完整的哺乳動(dòng)物ATP合酶結(jié)構(gòu),,兩種不同構(gòu)象的結(jié)構(gòu)不僅能夠完美的解釋哺乳動(dòng)物ATP合酶如何合成ATP分子,而且還鑒定了各個(gè)亞基在復(fù)合物中的位置和功能,。
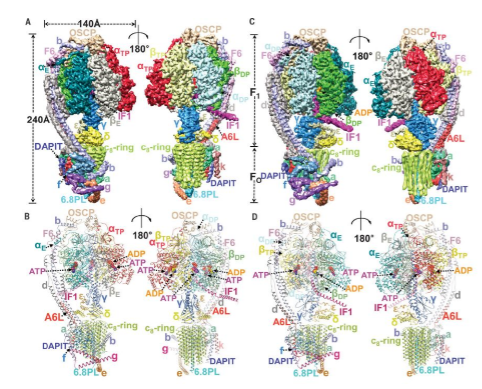
單個(gè)ATP合酶分子機(jī)器長(zhǎng)得跟我們常見(jiàn)的發(fā)電機(jī)非常類似,。在其跨膜區(qū)有一個(gè)由8個(gè)C1亞基構(gòu)成的類似于發(fā)電機(jī)線圈的結(jié)構(gòu),而跨膜區(qū)其它亞基共同構(gòu)成基座穩(wěn)定這一桶狀結(jié)構(gòu),。以往生化研究表明,,在線粒體膜間隙和胞質(zhì)間的線粒體內(nèi)膜兩側(cè)存在巨大的質(zhì)子濃度差。而這一質(zhì)子濃度差是由細(xì)胞內(nèi)通過(guò)消化食物中所獲得的能量分子上的高能電子在通過(guò)線粒體電子傳遞鏈蛋白復(fù)合物最終傳遞給我們呼吸所吸收的氧氣分子上生成水的過(guò)程中,,逆質(zhì)子濃度梯度從線粒體胞質(zhì)中泵到線粒體膜間隙中去的,。我們平常呼吸進(jìn)入體內(nèi)的氧氣大約有90%左右會(huì)在這一過(guò)程中被消耗掉。線粒體膜間隙的質(zhì)子會(huì)在內(nèi)膜兩側(cè)的質(zhì)子濃度差所帶來(lái)的電勢(shì)的驅(qū)動(dòng)下沿著8個(gè)C1亞基形成的桶狀結(jié)構(gòu)外圈環(huán)繞一圈后流入線粒體基質(zhì),,質(zhì)子的流動(dòng)會(huì)帶動(dòng)這一結(jié)構(gòu)在細(xì)胞膜內(nèi)轉(zhuǎn)動(dòng)進(jìn)而通過(guò)連接的桿狀結(jié)構(gòu)驅(qū)動(dòng)基質(zhì)側(cè)的三個(gè)催化活性中心在ADP上添加一個(gè)磷酸基團(tuán),,依次合成ATP分子。每8個(gè)質(zhì)子流過(guò)會(huì)驅(qū)動(dòng)桶狀結(jié)構(gòu)轉(zhuǎn)動(dòng)一圈,,同時(shí)會(huì)驅(qū)動(dòng)三個(gè)活性中心各合成一個(gè)ATP分子,。有意思的是在酵母中是由10個(gè)C1亞基形成的桶狀結(jié)構(gòu),所以需要10個(gè)質(zhì)子流過(guò)才能合成3個(gè)ATP分子,,而植物中是14個(gè)C1亞基形成桶狀結(jié)構(gòu),,故而合成效率是14個(gè)質(zhì)子流過(guò)才能合成3個(gè)ATP分子。這說(shuō)明高等生物中能量的利用率大大提高了,。物理學(xué)告訴我們,,所謂電流就是電子在導(dǎo)線中的同向位移,而電子設(shè)備在電流作用下做功,。同理,,在我們的線粒體中,質(zhì)子環(huán)繞ATP合酶C-ring運(yùn)動(dòng)促使其頭部做功,,合成ATP分子,。
基于結(jié)構(gòu),楊茂君團(tuán)隊(duì)發(fā)現(xiàn)ATP合酶四聚體很可能被至少三種機(jī)制抑制,。首先,,在線粒體基質(zhì)一側(cè),,IF1蛋白會(huì)將其N端深深的插入到一個(gè)ATP合酶具有催化活性的圓形的腦袋中間,跟連接跨膜區(qū)和腦袋的桿結(jié)合,,而其C端會(huì)形成一個(gè)長(zhǎng)的螺旋,。最有意思的是這個(gè)螺旋會(huì)在質(zhì)子濃度的調(diào)節(jié)下形成各種不同的聚合狀態(tài)。當(dāng)質(zhì)子濃度升高的時(shí)候它會(huì)形成二聚體,,進(jìn)而將ATP合酶四聚體中靠近一側(cè)的兩個(gè)腦袋給拉住,,抑制ATP合酶活性中心的運(yùn)動(dòng),從而使其不能合成ATP分子,。當(dāng)質(zhì)子濃度降低時(shí),,IF1蛋白會(huì)形成四聚體或者高聚體,從而將其N端從ATP合酶的腦袋中抽出來(lái),,解除這種抑制,,ATP合酶變成有活性的狀態(tài),進(jìn)而合成ATP,。
總之,,這一研究成果不僅首次發(fā)現(xiàn)、鑒定并解析了線粒體內(nèi)這一最重要的蛋白超級(jí)復(fù)合物的完整結(jié)構(gòu),,修正了以往科學(xué)發(fā)現(xiàn)中的錯(cuò)誤認(rèn)識(shí),,為人們深刻理解線粒體是如何合成我們維持生命所必需的能量分子ATP提供了全新的視角,同時(shí)也為我們深刻理解線粒體呼吸鏈相關(guān)疾病的預(yù)防和治療打下了良好的基礎(chǔ),,該研究將為人類的身體健康帶來(lái)重大而深遠(yuǎn)的影響,。 (文/黃銳)
參考文獻(xiàn)
1. Stock, D., Leslie, A.G.W. and Walker, J.E. (1999) Molecular architecture of the rotary motor in ATP synthase. Science 286, 1700-1705
2. Gu, Jinke et al., (2016). The architecture of the mammalian respirasome. Nature. 537.10.1038/nature19359.
3. Meng, Wu et al., (2016). Structure of Mammalian Respiratory Supercomplex I1III2IV1. Cell. 167. 1598-1609.e10. 10.1016/j.cell.2016.11.012.
4. Guo, Runyu et al,. (2017). Architecture of Human Mitochondrial Respiratory Megacomplex I 2 III 2 IV 2. Cell. 170. 10.1016/j.cell.2017.07.050.










 English
English


