真核細(xì)胞中,對(duì)環(huán)境和生物脅迫(如熱休克、氧化應(yīng)激,、病毒感染,、滲透應(yīng)激、紫外線照射或冷休克)的反應(yīng)機(jī)制之一是形成應(yīng)激顆粒(Stress granules,SGs),。SGs是細(xì)胞質(zhì)中含有mRNA和蛋白質(zhì)的無膜聚集體,,能夠協(xié)調(diào)細(xì)胞生長(zhǎng)和代謝以應(yīng)對(duì)環(huán)境變化,,從而使細(xì)胞適應(yīng)外界應(yīng)激源,。SGs的異常調(diào)控已被證實(shí)和多種疾病有關(guān),包括生殖,、衰老和神經(jīng)退行性疾病等,。目前,SGs的組成成份和組裝過程已有較多研究,,但調(diào)控SGs解聚的分子機(jī)制以及其在雄性生殖中的作用仍不清楚,。

2024年2月16日,華中科技大學(xué)同濟(jì)醫(yī)學(xué)院生殖健康研究所袁水橋教授,、王曉莉副教授團(tuán)隊(duì)在Cell子刊Cell Reports雜志上在線發(fā)表了題為“hnRNPA2B1 represses the disassembly of arsenite-induced stress granules and is essential for male fertility”的最新研究成果,。該研究揭示了hnRNPA2B1在調(diào)控生理性應(yīng)激顆粒和病理性應(yīng)激顆粒解聚過程中的保守作用,發(fā)現(xiàn)其缺失可特異性加快亞砷酸鹽誘導(dǎo)應(yīng)激顆粒的解聚速度,,并主要依賴于泛素化-蛋白酶體系統(tǒng),,而非自噬途徑。有趣的是,,該研究發(fā)現(xiàn)小鼠中敲除Hnrnpa2b1可導(dǎo)致唯支持細(xì)胞綜合征(Sertoli cell-only syndrome,,SCOS)發(fā)生,進(jìn)而引起雄性小鼠完全不育,,并發(fā)現(xiàn)敲除小鼠睪丸支持細(xì)胞中的應(yīng)激顆粒的解聚速度也同樣加快,。
2023年,袁水橋教授課題組發(fā)現(xiàn)RNA結(jié)合蛋白SERBP1可通過調(diào)節(jié)26S蛋白酶體活性和G3BP1泛素化的機(jī)制,,促進(jìn)體細(xì)胞和生殖細(xì)胞中的應(yīng)激顆粒(SG)清除,,并可保護(hù)熱激條件下的雄性生殖細(xì)胞損傷(Wang F, et al. Research, 2023)。為進(jìn)一步研究應(yīng)激顆粒在雄性生殖細(xì)胞的生理功能及形成/解聚機(jī)制,,課題組篩選出了核不均一核糖核蛋白hnRNPA2B1,,發(fā)現(xiàn)在正常情況下hnRNPA2B1主要定位于細(xì)胞核,而在應(yīng)激條件下,,其可定位于與多種刺激誘導(dǎo)的應(yīng)激顆粒上。在HeLa細(xì)胞中,,敲除hnRNPA2B1不影響細(xì)胞質(zhì)中亞砷酸鹽或熱應(yīng)激誘導(dǎo)的應(yīng)激顆粒的形成過程,,但在去除壓力的恢復(fù)期,敲除細(xì)胞中應(yīng)激顆粒的解聚速度明顯加快,,說明hnRNPA2B1能夠調(diào)控應(yīng)激顆粒的解聚過程,。通過進(jìn)一步的研究發(fā)現(xiàn),雖然敲除細(xì)胞中自噬水平發(fā)生了異常,,但是hnRNPA2B1調(diào)控應(yīng)激顆粒的解聚過程并不依賴于自噬過程,,而是經(jīng)由泛素化-蛋白酶體途徑。
隨后,課題組發(fā)現(xiàn)hnRNPA2B1能夠通過其C端結(jié)構(gòu)域與多個(gè)應(yīng)激顆粒核心蛋白相互作用,,包括在G3BP1,、USP10和Caprin-1等,并且其相互作用不依賴于RNA,。在亞砷酸鹽應(yīng)激條件下,,hnRNPA2B1的缺失導(dǎo)致G3BP1-USP10以及G3BP1- Caprin-1之間的相互作用減弱,并且G3BP1的泛素化水平升高,。為了研究G3BP1泛素化水平異常的原因,,研究人員著重研究了G3BP1-USP10的關(guān)系,發(fā)現(xiàn)USP10作為一個(gè)去泛素化酶,,G3BP1是其底物,,USP10可調(diào)控G3BP1的去泛素化。值得注意的是,,在hnRNPA2B1缺失后,,F(xiàn)US蛋白的病理突變體FUS-R521C從應(yīng)激顆粒上解聚的速度也明顯加快, 說明hnRNPA2B1在清除生理性和病理性應(yīng)激顆粒中的高度保守作用。這一結(jié)果表明,,在分子水平上,,hnRNPA2B1能夠和G3BP1相互作用,影響G3BP1和其它蛋白的相互作用強(qiáng)度及其泛素化水平,,進(jìn)而調(diào)空應(yīng)激顆粒的解聚過程,。
有趣的是,課題組進(jìn)一步研究發(fā)現(xiàn)hnRNPA2B1高表達(dá)于雄性小鼠睪丸細(xì)胞中,,包括支持細(xì)胞,、精母細(xì)胞和圓形精子細(xì)胞。通過構(gòu)建Hnrnpa2b1敲除小鼠模型,,發(fā)現(xiàn)Hnrnpa2b1敲除小鼠生長(zhǎng)發(fā)育情況沒有明顯異常,,但是雄性小鼠表現(xiàn)為唯支持細(xì)胞綜合征,最終完全不育,。從野生型和敲除小鼠睪丸中純化支持細(xì)胞后,,用亞砷酸鹽誘導(dǎo)應(yīng)激顆粒,發(fā)現(xiàn)與HeLa細(xì)胞中的結(jié)果相似,,且應(yīng)激顆粒在hnRNPA2B1缺失的支持細(xì)胞中,,解聚速度也明顯變快。
總的來說,,該研究通過細(xì)胞敲除和小鼠敲除模型,,揭示了hnRNPA2B1調(diào)控應(yīng)激顆粒解聚的分子機(jī)制,以及其在雄性生殖中的重要調(diào)控作用,,為由應(yīng)激壓力異常所致的疾病和男性不育提供了潛在的診療思路,。
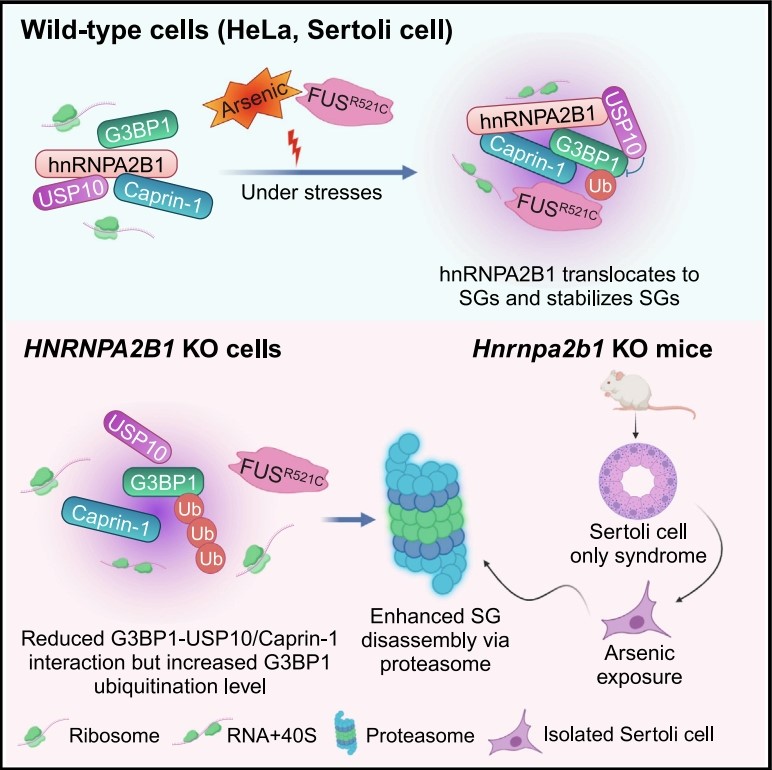
hnRNPA2B1調(diào)控應(yīng)激顆粒解聚和精子發(fā)生的模式圖
華中科技大學(xué)同濟(jì)醫(yī)學(xué)院生殖健康研究所王曉莉副教授,、碩士研究生范旭、博士研究生張進(jìn),、王鳳麗副教授為該論文的共同第一作者,,華中科技大學(xué)同濟(jì)醫(yī)學(xué)院生殖健康研究所袁水橋教授、王曉莉副教授為該論文的共同通訊作者,。該項(xiàng)研究得到了國(guó)家自然科學(xué)基金項(xiàng)目,、華中科技大學(xué)基礎(chǔ)研究計(jì)劃的大力支持。
原文鏈接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00097-4










 English
English


